Mga kategorya: Itinatampok na Mga Artikulo » Mga bagyong elektrisista
Bilang ng mga tanawin: 36288
Mga puna sa artikulo: 1
Mga mapagkukunan ng kimikal na kasalukuyang: pangunahing katangian
 Sa loob ng higit sa dalawang siglo, ang sangkatauhan ay gumagamit ng enerhiya ng mga reaksyon ng kemikal sa pagitan ng iba't ibang mga sangkap upang makabuo ng direktang kasalukuyang.
Sa loob ng higit sa dalawang siglo, ang sangkatauhan ay gumagamit ng enerhiya ng mga reaksyon ng kemikal sa pagitan ng iba't ibang mga sangkap upang makabuo ng direktang kasalukuyang.
Prinsipyo ng pagtatrabaho
Ang reaksyon ng redox na nagaganap sa pagitan ng mga sangkap na may mga katangian ng isang ahente ng oxidizing at isang pagbabawas ng ahente ay sinamahan ng pagpapalabas ng mga electron, ang paggalaw ng kung saan ay bumubuo ng isang electric current. Gayunpaman, upang magamit ang enerhiya nito, kinakailangan upang lumikha ng mga kondisyon para sa pagpasa ng mga elektron sa pamamagitan ng isang panlabas na circuit; kung hindi man, ito ay pinakawalan ng init mula sa isang simpleng halo ng isang ahente ng oxidizing at isang pagbabawas ng ahente.
Samakatuwid, ang lahat ng mga kasalukuyang mapagkukunan ng kemikal ay may dalawang electrodes:
-
ang anode kung saan nangyayari ang oksihenasyon;
-
katod na isinasagawa ang pagbawas ng isang sangkap.
Ang mga electrodes sa layo ay inilalagay sa isang sisidlan na may electrolyte - isang sangkap na nagsasagawa ng electric current dahil sa mga proseso ng dissociation ng medium sa mga ion.
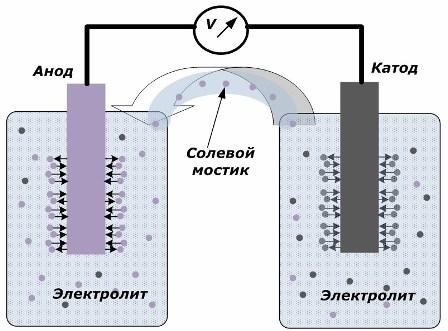
Ang prinsipyo ng pag-convert ng enerhiya ng kemikal sa elektrikal na enerhiya
Ipinapakita ng figure na ang mga electrodes ay inilalagay sa magkahiwalay na mga vessel na konektado ng isang tulay ng asin kung saan nilikha ang paggalaw ng mga ions kasama ang internal circuit. Kapag bukas ang panlabas at panloob na mga circuit, dalawang proseso ang nangyayari sa mga electrodes: ang paglipat ng mga ion mula sa metal ng elektrod sa electrolyte at paglipat ng mga ion mula sa electrolyte hanggang sa kristal na lattice ng mga electrodes.
Ang mga rate ng daloy ng mga prosesong ito ay pareho at ang mga potensyal ng boltahe ng kabaligtaran na mga palatandaan ay naipon sa bawat elektrod. Kung sila ay konektado sa pamamagitan ng isang tulay ng asin at inilalapat ang isang pag-load, magaganap ang isang de-koryenteng circuit. Ang isang panloob na kasalukuyang ay nabuo ng paggalaw ng mga ion sa pagitan ng mga electrodes sa pamamagitan ng electrolyte at tulay ng asin. Ang paggalaw ng mga electron kasama ang panlabas na circuit sa direksyon mula sa anode hanggang sa katod.
Halos lahat ng mga reaksyon ng redox ay sinamahan ng henerasyon ng koryente. Ngunit ang halaga nito ay nakasalalay sa maraming mga kadahilanan, kabilang ang mga dami at masa ng mga kemikal na ginamit, ang mga materyales na ginamit upang gawin ang mga electrodes, tulad ng electrolyte, konsentrasyon ng ion, disenyo.
Ang pinaka-malawak na ginagamit sa modernong mapagkukunan ng kemikal na kasalukuyang ay:
-
para sa materyal ng anode (pagbabawas ng ahente), sink (Zn), tingga (Pb), cadmium (Cd), at ilang iba pang mga metal;
-
para sa materyal ng katod (oxidizer) - humantong oxide PbO2, manganese oxide MnO2, nickel hydroxide NiOOH at iba pa;
-
electrolyte batay sa mga solusyon ng mga acid, alkalis o asing-gamot.
Mga Paraan ng Pag-uuri
Ang isang bahagi ng mga mapagkukunan ng lakas ng kemikal ay maaaring magamit muli, habang ang iba ay hindi. Ang prinsipyong ito ay kinuha bilang batayan para sa kanilang pag-uuri.
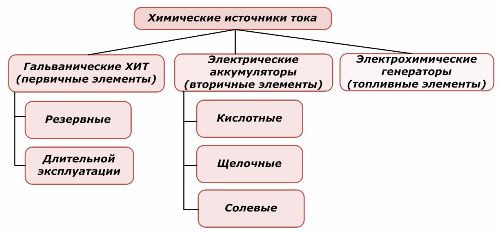
Pag-uuri ng mga elemento ng kemikal
Lakas ng elektromotiko galvanic cells, depende sa disenyo, umabot sa 1.2 ÷ 1.5 volts. Upang makakuha ng malalaking halaga, pinagsama sila sa mga baterya, pagkonekta sa serye. Kapag ang mga baterya ay konektado sa kahanay, kasalukuyang at pagtaas ng kuryente.
Karaniwang tinatanggap na ang pangunahing mga kasalukuyang mapagkukunan ng kemikal ay hindi sumusuporta sa muling pag-recharging, bagaman mas tumpak na ang posisyon na ito ay maaaring formulate nang naiiba: ang pagpapatupad nito ay hindi matipid.
Ang kalabisan ng pangunahing mapagkukunan ng kasalukuyang kemikal ay naka-imbak sa isang estado kung saan ang electrolyte ay nakahiwalay sa mga electrodes. Tinatanggal nito ang paglitaw ng reaksyon ng redox at tinitiyak ang pagiging handa para sa komisyon. Hindi sila muling ginagamit. Ang buhay ng istante ng mga mapagkukunang backup ng kemikal na backup ay limitado sa 10-15 taon.
Ang mga baterya ay matagumpay na na-recharged ng aplikasyon ng panlabas na elektrikal na enerhiya. Dahil sa tampok na ito, tinawag silang pangalawang kasalukuyang mapagkukunan. Nagawa nilang makatiis daan-daang at libu-libong mga siklo ng pag-charge-discharge.Ang EMF ng baterya ay maaaring nasa saklaw ng 1.0 ÷ 1.5 volts. Ang mga ito ay pinagsama din sa mga baterya.
Gumagawa ang mga electrochemical generators sa prinsipyo ng mga galvanic cells, ngunit upang maisagawa ang reaksiyong electrochemical, ang mga sangkap ay nagmula sa labas, at ang lahat ng mga pinakawalan na produkto ay tinanggal mula sa electrolyte. Pinapayagan ka nitong ayusin ang isang tuluy-tuloy na proseso.
Mga pangunahing katangian ng pagganap ng mga mapagkukunan ng lakas ng kemikal
1. Ang boltahe sa mga bukas na mga terminal
Depende sa disenyo, ang isang solong mapagkukunan ay maaaring lumikha lamang ng isang tiyak na potensyal na pagkakaiba. Para sa paggamit sa mga de-koryenteng aparato, pinagsama sila sa mga baterya.
2. Tukoy na kapasidad
Para sa isang tiyak na oras (sa mga oras) ang isang kasalukuyang kasalukuyang kemikal ay maaaring makabuo ng isang limitadong dami ng kasalukuyang (sa mga amperes), na iniugnay sa isang yunit ng timbang o dami.
3. Kapadali ng lakas
Nailalarawan nito ang kakayahan ng isang yunit ng timbang o dami ng isang kasalukuyang mapagkukunan ng kemikal upang makabuo ng kapangyarihan na nabuo ng produkto ng boltahe sa pamamagitan ng kasalukuyang lakas.
4. Tagal ng operasyon
Ang parameter na ito ay tinatawag ding petsa ng pag-expire.
5. Ang halaga ng mga pagdidilig sa sarili
Ang mga side process na electrochemical reaksyon ay humantong sa pagkonsumo ng aktibong masa ng mga elemento, nagiging sanhi ng kaagnasan, at binawasan ang tiyak na kapasidad.
6. Presyo ng produkto
Nakasalalay sa disenyo, mga materyales na ginamit at isang bilang ng iba pang mga kadahilanan.
Ang pinakamahusay na mapagkukunan ng kasalukuyang mapagkukunan ay ang mga may mataas na halaga ng unang apat na mga parameter, at ang self-discharge at gastos ay mababa.
Mga Prinsipyo ng Charter Charge
Kabilang sa pangalawang mapagkukunan ng pangalawang kemikal, nakakakuha sila ng mahusay na katanyagan. lithium ion models, na naging malawak na ginamit sa kapangyarihan ng mga elektronikong aparato. Ginagamit nila ang LiMO2 (M Co, Ni, Mn) bilang materyal ng positibong elektrod, at grapayt bilang negatibong elektrod.
Kapag sisingilin, ang mga lithium ion mula sa inilapat na panlabas na enerhiya ay pinakawalan mula sa cathode metal, dumaan sa electrolyte at tumagos sa puwang sa pagitan ng mga grapayt na layer, na nakaipon doon.
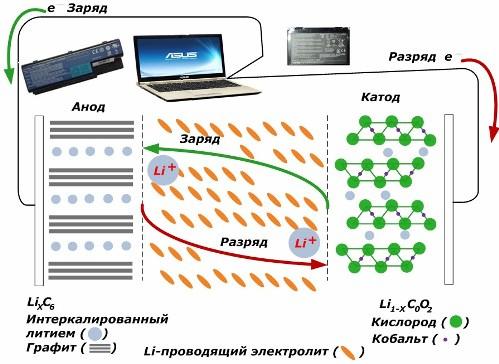
Kapag ang lakas charger ay wala, at ang pag-load ay konektado sa mga electrodes, pagkatapos ay ang mga lithium ions sa electrolyte ilipat sa kabaligtaran na direksyon.
Kung ang singil at paglabas ay hindi isinasagawa, pagkatapos ang enerhiya sa baterya ay hindi natupok, ngunit nakaimbak. Ngunit ang dami nito ay limitado sa pamamagitan ng mga katangian ng mga materyales na ginamit. Halimbawa, sa mga baterya ng lithium-ion, ang tiyak na kapasidad ng kuryente ay 130 ÷ 150 mAh / g. Ito ay limitado sa pamamagitan ng mga katangian ng materyal na anode. Para sa grapayt, ang kapasidad ay halos dalawang beses na mas mataas.
Ang mga siyentipiko ay naghahanap ngayon ng mga paraan upang madagdagan ang kapasidad ng baterya, sinaliksik ang posibilidad ng paggamit ng isang reaksiyong kemikal sa pagitan ng lithium at oxygen sa hangin. Upang gawin ito, ang mga disenyo ay binuo ng isang hangin, di-mabibigat na katod, na ginagamit sa magkakahiwalay na mga baterya. Ang pamamaraang ito ay maaaring dagdagan ang density ng enerhiya hanggang sa 10 beses.
Ang pagpapatakbo ng mga kasalukuyang mapagkukunan ng kemikal ay nangangailangan ng kaalaman mga batayan ng electrical engineering, electrochemistry, science science at solid state physics.
Tingnan din sa electro-tl.tomathouse.com
:
