Mga kategorya: Itinatampok na Mga Artikulo » Mga bagyong elektrisista
Bilang ng mga tanawin: 70526
Mga puna sa artikulo: 0
Mga cell Galvanic - aparato, prinsipyo ng operasyon, uri at pangunahing katangian
Mga kinakailangan para sa hitsura ng mga galvanic cells. Kaunting kasaysayan. Noong 1786, ang propesor ng gamot sa Italya, ang physiologist na si Luigi Aloisio Galvani ay natuklasan ang isang kagiliw-giliw na kababalaghan: ang mga kalamnan ng mga binti ng hind ng isang sariwang binuksan na bangkay ng isang palaka na sinuspinde sa mga kawit ng tanso na kinontrata nang hinawakan sila ng siyentista ng isang bakal na scalpel. Agad na natapos ni Galvani na ito ay isang pagpapakita ng "koryente ng hayop."
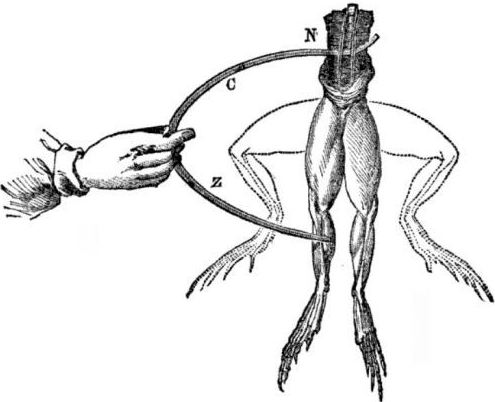
Matapos ang pagkamatay ni Galvani, ang kanyang kontemporaryong si Alessandro Volta, bilang isang chemist at pisiko, ay ilalarawan at ipakita sa publiko ang isang mas makatotohanang mekanismo para sa paglitaw ng electric current sa pakikipag-ugnay sa iba't ibang mga metal.
Ang Volta, pagkatapos ng isang serye ng mga eksperimento, ay darating sa hindi patas na konklusyon na ang kasalukuyang lumilitaw sa circuit dahil sa pagkakaroon nito ng dalawang conductor ng iba't ibang mga metal na inilagay sa isang likido, at hindi ito sa lahat ng "koryente ng hayop", tulad ng naisip ni Galvani. Ang twitching ng mga binti ng palaka ay isang kinahinatnan ng pagkilos ng kasalukuyang lumabas mula sa pakikipag-ugnay ng iba't ibang mga metal (mga kawit ng tanso at isang scalpel ng bakal).
Ang Volta ay magpapakita ng magkakatulad na mga kababalaghan na ipinakita ni Galvani sa isang patay na palaka, ngunit sa isang ganap na walang buhay na electrometer na homemade, at noong 1800 ay magbibigay ng isang tumpak na paliwanag sa kasalukuyang: "ang pangalawang-klase conductor (likido) ay nasa gitna at nakikipag-ugnay sa dalawang first-class conductors ng dalawang magkaibang Mga metal ... Bilang resulta nito, isang de-koryenteng kasalukuyang ng isang direksyon o isa pang bumangon. "

Sa isa sa mga unang eksperimento, ibinaba ni Volta ang dalawang plato - zinc at tanso - sa isang garapon ng acid at ikinonekta ang mga ito sa wire. Pagkatapos nito, ang zinc plate ay nagsimulang matunaw, at ang mga bula ng gas na nabuo sa bakal na tanso. Iminungkahi ni Volta at pinatunayan na ang isang de-koryenteng kasalukuyang dumadaloy sa pamamagitan ng kawad.
Sa gayon ay naimbento ang "elemento ng Volta" - ang unang galvanic cell. Para sa kaginhawahan, binigyan siya ng Volta ng hugis ng isang patayong silindro (haligi), na binubuo ng magkakaugnay na mga singsing ng sink, tanso at tela na pinapagbinhi ng acid. Ang isang boltahe na poste kalahating metro mataas na lumikha ng isang sensitibong boltahe sa mga tao.
Dahil ang simula ng pananaliksik ay inilatag ni Luigi Galvani, ang pangalan mapagkukunan ng kemikal kasalukuyang pinangalagaan ang memorya sa kanya sa kanyang pangalan.
Galvanic cell Ay isang mapagkukunan ng kemikal ng kasalukuyang electric, batay sa pakikipag-ugnayan ng dalawang metal at / o ang kanilang mga oxides sa isang electrolyte, na humahantong sa hitsura ng isang electric current sa isang closed circuit. Kaya, sa mga cell galvanic, ang enerhiya ng kemikal ay na-convert sa elektrikal na enerhiya.
Mga Cell Ngayon

Ang mga cell ngayon ay tinatawag na mga baterya. Ang tatlong uri ng mga baterya ay laganap: saline (tuyo), alkalina (tinatawag din silang alkalina, "alkalina" sa pagsasalin mula sa Ingles - "alkalina") at lithium. Ang prinsipyo ng kanilang trabaho ay katulad ng inilarawan ni Volta noong 1800: dalawang metal makipag-ugnay sa pamamagitan ng electrolyte, at isang de-koryenteng kasalukuyang lumitaw sa isang panlabas na saradong circuit.
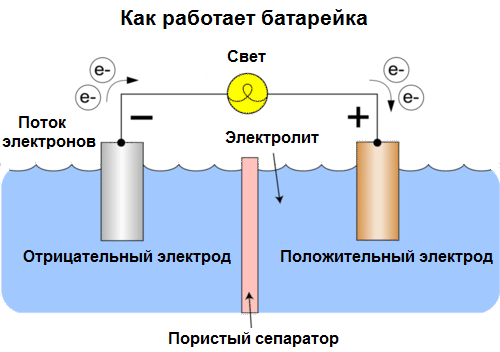
Ang boltahe ng baterya ay nakasalalay sa mga metal na ginamit, at sa bilang ng mga cell sa "baterya". Ang mga baterya, hindi katulad ng mga baterya, ay hindi may kakayahang ibalik ang kanilang mga pag-aari, dahil direkta silang nagko-convert ng kemikal na enerhiya, iyon ay, ang enerhiya ng mga reagents (reductant at oxidizer) na bumubuo sa baterya, sa elektrikal na enerhiya.
Ang mga reagents na kasama sa baterya ay natupok sa panahon ng pagpapatakbo nito, ang kasalukuyang unti-unting bumababa, samakatuwid, ang pagkilos ng mapagkukunan ay nagtatapos matapos ang mga reagents na ganap na gumanti.
Ang mga elemento ng alkalina at asin (baterya) ay malawak na ginagamit upang mabigyan ng kapangyarihan ang iba't ibang mga elektronikong aparato, kagamitan sa radyo, laruan, at lithium ay madalas na matatagpuan sa mga portable na aparatong medikal tulad ng mga metro ng glucose ng dugo o sa digital na teknolohiya tulad ng mga camera.

Mga baterya ng asin
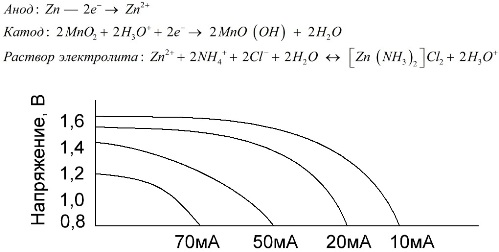
Ang mga cell ng Manganese-zinc, na tinatawag na salt baterya, ay "dry" galvanic cells, sa loob kung saan walang likido na electrolyte solution.
Ang isang zink elektrod (+) ay isang cathode na may hugis ng tasa, at isang halo ng pulbos ng manganese dioxide na may grapayt. Kasalukuyang dumadaloy sa isang grapik na baras. Bilang isang electrolyte, ang isang i-paste ay ginagamit mula sa isang solusyon ng ammonium klorido na may pagdaragdag ng almirol o harina upang maging makapal, upang walang dumadaloy.
Karaniwan, ang mga tagagawa ng baterya ay hindi nagpapahiwatig ng eksaktong komposisyon ng mga elemento ng asin, gayunpaman, ang mga baterya ng asin ay ang pinakamurang, karaniwang ginagamit ito sa mga aparato kung saan napakababa ng pagkonsumo ng kuryente: sa mga oras, sa mga malayuang kontrol, sa mga elektronikong thermometer, atbp.

Ang konsepto ng "nominal na kapasidad" ay bihirang ginagamit upang makilala ang mga baterya ng manganese-zinc, dahil ang kanilang kapasidad ay lubos na nakasalalay sa mga kondisyon at kondisyon ng operating. Ang pangunahing kawalan ng mga elementong ito ay isang makabuluhang rate ng pagbawas ng boltahe sa buong paglabas at isang makabuluhang pagbaba sa kapasidad ng output na may pagtaas ng kasalukuyang paglabas. Ang panghuling boltahe ng paglabas ay nakatakda depende sa pagkarga sa saklaw ng 0.7-1.0 V.
Mahalaga hindi lamang ang kadakilaan ng kasalukuyang naglalabas, kundi pati na rin ang iskedyul ng oras ng pagkarga. Sa mga pansamantalang paglabas ng mga malaki at daluyan ng mga alon, ang pagganap ng mga baterya ay nagdaragdag nang malaki kumpara sa patuloy na operasyon. Gayunpaman, sa mga maliliit na alon ng paglabas at buwan ng mga pagkagambala sa pagpapatakbo, ang kanilang kapasidad ay maaaring bumaba bilang isang resulta ng paglabas sa sarili.
Ang graph sa itaas ay nagpapakita ng mga curves ng paglabas para sa isang average na baterya ng asin para sa 4, 10, 20, at 40 na oras para sa paghahambing sa isang alkalina, na tatalakayin sa ibang pagkakataon.
Mga baterya ng alkalina (alkalina)
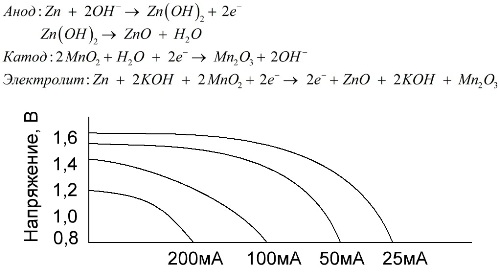
Ang isang baterya ng alkalina ay isang baterya ng galvanic ng manganese-zinc, kung saan ginagamit ang manganese dioxide bilang isang katod, ang zink na pulbos ay ginagamit bilang isang anode, at isang solusyon ng alkali ay ginagamit bilang isang electrolyte, karaniwang sa anyo ng isang potasa na hydroxide paste.
Ang mga baterya na ito ay may isang bilang ng mga pakinabang (sa partikular, isang makabuluhang mas malaking kapasidad, mas mahusay na pagganap sa mababang temperatura at mataas na pag-load ng mga alon).

Ang mga baterya ng alkalina, kung ihahambing sa asin, ay maaaring magbigay ng higit pang kasalukuyang sa loob ng mahabang panahon. Ang isang mas malaking kasalukuyang nagiging posible dahil ang zinc ay ginagamit dito hindi sa anyo ng isang baso, ngunit sa anyo ng isang pulbos na mayroong isang mas malaking lugar ng pakikipag-ugnay sa electrolyte. Ang potassium hydroxide sa anyo ng isang i-paste ay ginagamit bilang isang electrolyte.
Salamat sa kakayahan ng ganitong uri ng mga galvanic cells upang makapaghatid ng isang makabuluhang kasalukuyang (hanggang sa 1 A) sa loob ng mahabang panahon, ang mga baterya ng alkalina ay karaniwang pangkaraniwan sa kasalukuyan.
Sa mga de-koryenteng laruan, sa portable na medikal na kagamitan, sa mga elektronikong aparato, sa mga camera, ang mga alkalina na baterya ay ginagamit saanman. Naghahatid sila ng 1.5 beses na mas mahaba kaysa sa asin kung mababa ang paglabas. Ipinapakita ng graph ang mga curves ng paglabas sa iba't ibang mga alon para sa paghahambing sa isang baterya ng asin (ang graph ay ibinigay sa itaas) para sa 4, 10, 20 at 40 na oras.
Mga baterya ng Lithium
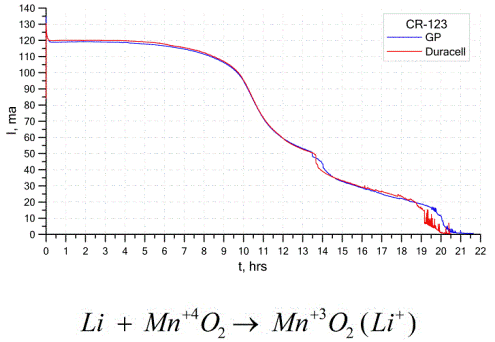
Ang isa pang medyo karaniwang uri ng mga galvanic cells ay mga baterya ng lithium - mga solong non-rechargeable galvanic cells kung saan ang lithium o mga compound nito ay ginagamit bilang isang anode. Dahil sa paggamit ng alkali metal, mayroon silang mataas na potensyal na pagkakaiba.

Ang katod at electrolyte ng isang lithium cell ay maaaring magkakaiba, kaya't ang salitang "lithium cell" ay pinagsasama ang isang pangkat ng mga cell na may parehong materyal na anode.Bilang isang katod, halimbawa, maaaring gamitin ang manganese dioxide, carbon monofluoride, pyrite, thionyl chloride, atbp.
Ang mga baterya ng Lithium ay nakikilala mula sa iba pang mga baterya sa pamamagitan ng kanilang mataas na runtime at mataas na gastos. Depende sa napiling laki at mga kemikal na materyales na ginamit, ang isang baterya ng lithium ay maaaring makagawa ng mga boltahe mula sa 1.5 V (katugma sa mga baterya ng alkalina) hanggang sa 3.7 V.
Ang mga baterya na ito ay may pinakamataas na kapasidad sa bawat yunit ng masa at mahabang istante ng buhay. Ang mga selula ng lithium ay malawakang ginagamit sa mga modernong portable electronic na kagamitan: para sa mga powering relo sa mga motherboards ng computer, para sa powering portable na medikal na aparato, relo, calculators, sa mga kagamitan sa photographic, atbp.
Ang graph sa itaas ay nagpapakita ng mga curves ng paglabas para sa dalawang baterya ng lithium mula sa dalawang tanyag na tagagawa. Ang paunang kasalukuyang ay 120 mA (bawat resistor ng pagkakasunud-sunod ng 24 Ohms).
Tingnan din: Mga modernong baterya na maaaring ma-rechargeable - kalamangan at kawalan
Tingnan din sa electro-tl.tomathouse.com
: