Mga kategorya: Mga bagyong elektrisista, Pang-industriya ng elektrisidad
Bilang ng mga tanawin: 37528
Mga puna sa artikulo: 0
Ang praktikal na aplikasyon ng electrolysis
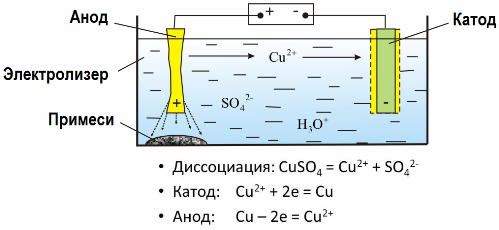
Kapag ang isang de-koryenteng kasalukuyang pumasa sa isang solusyon o isang matunaw ng isang electrolyte, natunaw na mga electrodes o iba pang mga sangkap na mga produkto ng pangalawang reaksyon sa mga electrodes ay inilabas sa mga electrodes. Ang prosesong physicochemical na ito ay tinatawag na electrolysis.
Ang kakanyahan ng electrolysis
Sa electric field na nilikha ng mga electrodes, ang mga ion sa pagsasagawa ng likido ay nagmumula sa isang order na paggalaw. Ang negatibong elektrod ay ang katod, ang positibo ay ang anode.
Ang mga negatibong ion na tinatawag na anion (mga ions ng pangkat ng hydroxyl at residue ng acid) ay sumugod sa anode, at ang mga positibong ion na tinatawag na mga kasyon (hydrogen, metal, ammonium ion, atbp.) Pagmamadali sa cathode
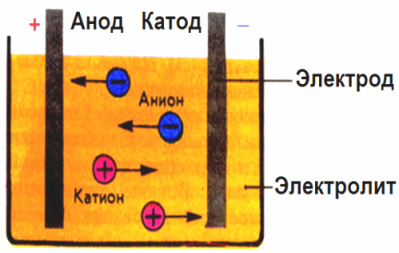
Ang isang proseso ng pagbabawas ng oksihenasyon ay nagaganap sa mga electrodes: pagbabawas ng electrochemical ng mga particle (atoms, molecules, cations) ay nangyayari sa katod, at electrochemical oksihenasyon ng mga particle (atoms, molekula, anion) ay nangyayari sa anode. Ang mga reaksyon ng disociasyon sa isang electrolyte ay pangunahing reaksyon, at ang mga reaksyon na dumidiretso sa mga electrodes ay tinatawag na pangalawa.
Ang mga batas ng Faraday electrolysis
Ang paghihiwalay ng mga reaksyon ng electrolysis sa pangunahing at pangalawa ay nakatulong kay Michael Faraday na maitaguyod ang mga batas ng electrolysis:
-
Ang unang batas ng Faraday electrolysis: ang masa ng sangkap na idineposito sa elektrod sa panahon ng electrolysis ay direktang proporsyonal sa dami ng kuryente na inilipat sa elektrod na ito. Sa pamamagitan ng dami ng koryente ay nangangahulugang isang singil ng kuryente, sinusukat, bilang isang panuntunan, sa mga pendant.
-
Ang pangalawang batas ng Faraday electrolysis: para sa isang naibigay na halaga ng kuryente (singil ng kuryente), ang masa ng isang elemento ng kemikal na idineposito sa elektrod ay direktang proporsyonal sa katumbas na masa ng elemento. Ang katumbas na masa ng isang sangkap ay ang molar mass na hinati ng isang integer, depende sa reaksiyong kemikal kung saan kasangkot ang sangkap.
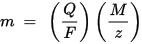
m ay ang masa ng sangkap na idineposito sa elektrod, Q ang kabuuang singil ng kuryente na dumadaan sa sangkap F = 96,485.33 (83) C mol - 1 ay ang parating Faraday, M ay ang molar mass ng sangkap (Halimbawa, ang molar mass ng tubig H2O = 18 g / mol), z ang bilang ng valence number ng mga ion ng isang sangkap (ang bilang ng mga electron bawat ion).
Tandaan na ang M / z ay ang katumbas na masa ng pinalamig na sangkap. Para sa unang batas ng Faraday, ang M, F at z ay patuloy, kaya mas malaki ang halaga ng Q, mas malaki ang halaga ng m. Para sa pangalawang batas ng Faraday, ang Q, F at z ay patuloy, kaya mas malaki ang halaga ng M / z (katumbas na masa), mas malaki ang halaga ng m.
Ang elektrolisis ay malawakang ginagamit ngayon sa industriya at sa teknolohiya. Halimbawa, ito ay electrolysis na nagsisilbing isa sa mga pinaka-epektibong pamamaraan para sa pang-industriya na produksyon ng hydrogen, hydrogen peroxide, manganese dioxide, aluminyo, sodium, magnesium, calcium at iba pang mga sangkap. Ginagamit ang elektrolisis upang gamutin ang wastewater, sa electroplating, sa electroplating, at sa wakas sa mga kasalukuyang mapagkukunan ng kemikal. Ngunit unang bagay muna.
Pagkuha ng purong metal mula sa ores sa pamamagitan ng electrolysis
Salamat sa electrolysis, maraming mga metal ang nakuha mula sa ores at sumailalim sa karagdagang pagproseso. Kaya, kapag ang mineral o yaman na mineral - tumutok - ay ginagamot ng mga reagents, ang metal ay ipinapasa sa solusyon, at pagkatapos, sa pamamagitan ng electroextraction, ang metal ay nakahiwalay mula sa solusyon. Ang purong metal ay pinakawalan sa katod. Sa ganitong paraan makatanggap ng sink, tanso, cadmium.
Ang mga metal ay sumailalim sa electrorefining upang maalis ang mga impurities at i-convert ang mga nakapaloob na mga impurities sa isang form na maginhawa para sa karagdagang pagproseso. Ang metal na malinis ay inihagis sa anyo ng mga plato, at ang mga plato na ito ay ginagamit bilang anodes sa electrolysis.
Kapag ang kasalukuyang pumasa, ang metal ng anode ay natunaw, ipinapasa sa anyo ng mga kation papunta sa solusyon, pagkatapos ang mga cation ay pinalabas sa katod at bumubuo ng isang pag-uusig ng purong metal. Ang mga impurities ng anode ay hindi natutunaw - sila ay tumatagal sa slurry ng anode, o pumasa sa electrolyte, mula kung saan sila ay patuloy o pana-panahong tinanggal.
Isaalang-alang bilang isang halimbawa tanso electrorefining. Ang pangunahing sangkap ng solusyon - tanso sulpate - ang pinakakaraniwan at pinakamurang asin ng metal na ito. Ang solusyon ay may isang mababang koryente na kondaktibiti. Upang madagdagan ito, ang asupre na acid ay idinagdag sa electrolyte.
Bilang karagdagan, ang mga maliliit na halaga ng mga additives ay ipinakilala sa solusyon upang mapadali ang pagbuo ng isang compact metal mendakan. Sa pangkalahatan, ang tanso, nikel, tingga, lata, pilak, at ginto ay napapailalim sa pagpapino ng electrolytic.
Paggamot ng Elektrolisis Wastewater
Ang elektrolisis ay ginagamit sa paggamot ng wastewater (mga proseso ng electrocoagulation, electroextraction at electroflotation). Ang pamamaraan ng paglilinis ng electrochemical ay isa sa mga karaniwang ginagamit. Para sa electrolysis, ang hindi malulutas na anod (magnetite, lead oxide, grapayt, manganese, na idineposito sa isang titanium base), o natutunaw (aluminyo, bakal) ay ginagamit.
Ang pamamaraang ito ay ginagamit upang ibukod ang nakakalason na organikong at hindi organikong sangkap mula sa tubig. Halimbawa, ang mga tubo ng tanso ay nalinis ng scale na may solusyon ng sulpuriko acid, at ang industriyang wastewater ay dapat pagkatapos ay linisin ng electrolysis na may isang hindi matutunaw na anode. Ang Copper ay pinakawalan sa katod, na maaaring magamit muli sa parehong kumpanya.
Ang alkantarilya ng alkalina ay nalinis ng electrolysis mula sa mga compound ng cyanide. Upang mapabilis ang oksihenasyon ng cyanides, dagdagan ang kuryente at pag-save ng enerhiya, isang additive sa anyo ng sodium chloride ay ginagamit sa tubig.
Ang elektrolisis ay isinasagawa gamit ang isang grapayt na anode at isang bakal na katod. Ang mga cyanides ay nawasak sa panahon ng electrochemical oksihenasyon at klorin, na pinakawalan sa anode. Ang pagiging epektibo ng naturang paglilinis ay malapit sa 100%.
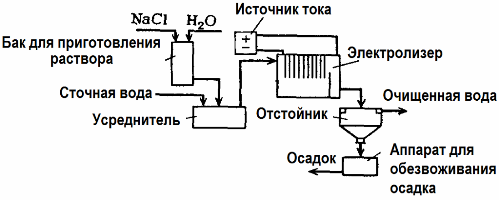
Bilang karagdagan sa direktang paglilinis ng electrochemical, maaari itong isama sa proseso ng electrolysis coagulation. Hindi kasama ang pagdaragdag ng mga asing-gamot, ang electrolysis ay isinasagawa gamit ang natutunaw na aluminyo o iron anodes. Kung gayon hindi lamang ang mga kontaminado sa anod ay nawasak, ngunit ang anode mismo ay natunaw. Ang mga aktibong nakakalat na compound ay nabuo na coagulate (palalimin) na mga nakakalat na colloidal na nakakalat.
Ang pamamaraang ito ay epektibo sa pagpapagamot ng wastewater mula sa mga taba, mga produktong langis, tina, langis, radioactive na sangkap, atbp Ito ay tinatawag na electrocoagulation.
Electroplating
Ang electroplating ay ang pagpapalabas ng electrolytic ng ilang mga metal upang maprotektahan ang mga produkto mula sa kaagnasan at upang mabigyan sila ng isang naaangkop na hitsura ng aesthetic (coating ay ginawa gamit ang kromium, nikel, pilak, ginto, platinum, atbp.). Ang bagay ay lubusan na nalinis, nababawas, at ginamit bilang isang katod sa isang electrolytic bath kung saan ang isang solusyon ng asin ng metal na kung saan kinakailangan na isawsaw ang produkto ay ibuhos.
Ang isang plato ng parehong metal ay ginagamit bilang anode. Bilang isang patakaran, ginagamit ang isang pares ng mga anode plate, at ang paksa na mai-galvanis ay inilalagay sa pagitan nila.
Electroforming
Electroplating - ang pag-aalis ng metal sa ibabaw ng iba't ibang mga katawan upang muling kopyahin ang kanilang mga hugis: mga hulma para sa mga bahagi ng paghahagis, mga eskultura, naka-print na cliches, atbp.

Ang pag-aalis ng Galvanic ng metal sa ibabaw ng isang bagay ay posible lamang kapag ang ibabaw o ang buong bagay ay isang electric kasalukuyang conductor, kaya ipinapayong gamitin ang mga metal upang makagawa ng mga modelo o form. Ang mga maaasahang metal ay pinaka-angkop para sa layuning ito: tingga, lata, mga nagbebenta, haluang metal.
Ang mga metal na ito ay malambot, madaling naproseso gamit ang mga tool na gawa sa metal, ay maayos na naka-ukit at cast. Matapos mabuo ang layer ng galvanic at pagtatapos, ang amag na metal ay pinahiran mula sa natapos na produkto.
Gayunpaman, ang pinakadakilang mga pagkakataon para sa paggawa ng mga modelo ay kinakatawan pa rin ng mga dielectric na materyales. Upang ma-metallize ang gayong mga modelo, kinakailangan upang bigyan ang kanilang ibabaw ng koryente na conductivity. Ang tagumpay o pagkabigo sa huli ay nakasalalay sa pangunahing kalidad ng conductive layer. Ang layer na ito ay maaaring mailapat sa isa sa tatlong mga paraan.
Ang pinaka-karaniwang paraan ay pag-graphicize, angkop ito para sa mga modelo ng plasticine at iba pang mga materyales na nagpapahintulot sa paggiling ng grapayt sa ibabaw.
Ang susunod na trick ay bronzing, ang pamamaraan ay mabuti para sa mga modelo ng medyo kumplikadong hugis, para sa iba't ibang mga materyales, gayunpaman, dahil sa kapal ng layer ng tanso, ang paglipat ng mga maliliit na detalye ay medyo nagulong.
At sa wakas pagpupunoangkop sa lahat ng mga kaso, ngunit lalo na kailangang-kailangan para sa mga marupok na modelo na may napaka kumplikadong hugis - mga halaman, insekto, atbp.
Mga mapagkukunan ng kemikal na kasalukuyang
Gayundin, ang electrolysis ay ang pangunahing proseso dahil sa kung saan ang pinaka-modernong kemikal na kasalukuyang mapagkukunan, tulad ng mga baterya at mga nagtitipon, gumana. Mayroong dalawang mga electrodes na nakikipag-ugnay sa electrolyte.
Ang isang potensyal na pagkakaiba ay itinatag sa pagitan ng mga electrodes - isang puwersa ng elektromotiko na naaayon sa libreng enerhiya ng reaksyon ng redox. Tingnan dito para sa karagdagang mga detalye: Mga mapagkukunan ng kemikal ng kasalukuyang electric
Baterya ng Lemon (mag-click sa larawan upang palakihin)
Ang pagkilos ng mga kasalukuyang mapagkukunan ng kemikal ay batay sa paglitaw ng mga spatially na pinaghiwalay na mga proseso na may isang saradong panlabas na circuit: sa negatibong anode, ang pagbabawas ng ahente ay na-oxidized, ang mga libreng elektron na nabuo ay pumasa sa panlabas na circuit sa positibong katod, lumilikha ng isang paglabas ng kasalukuyang, kung saan lumahok sila sa reaksyon ng pagbawas ng oksihenasyon. Kaya, ang daloy ng negatibong mga sisingilin ng mga elektron kasama ang panlabas na circuit ay mula sa anode patungo sa katod, iyon ay, mula sa negatibong elektrod hanggang sa positibo.
Tingnan din sa electro-tl.tomathouse.com
: